缺血性脑卒中是威胁人类健康和生存的重大疾病之一,具有较高的发病率和死亡率。目前临床治疗的主要途径是尽快恢复缺血区域的血液再灌注,使脑组织得到血氧的再补给。然而,脑再灌注后过度的免疫反应往往会进一步加重神经系统的病理损伤,加重临床症状,从而影响脑卒中患者的预后。因此,快速有效地调节大脑复杂多变的免疫环境,使其处于正常状态,对减少再灌注损伤、提高长期生存率至关重要。脑内驻留的小胶质细胞和外周浸润的炎性细胞导致复杂和过度激活的脑免疫微环境,是缺血性脑卒中后神经恢复的主要障碍。因此,如何制备一种简单、安全的纳米平台,用于内部(小胶质细胞、高ROS环境)和外部(外周浸润的炎症细胞)协同管理过度激活的脑免疫微环境,是缺血性卒中治疗的一个巨大挑战。

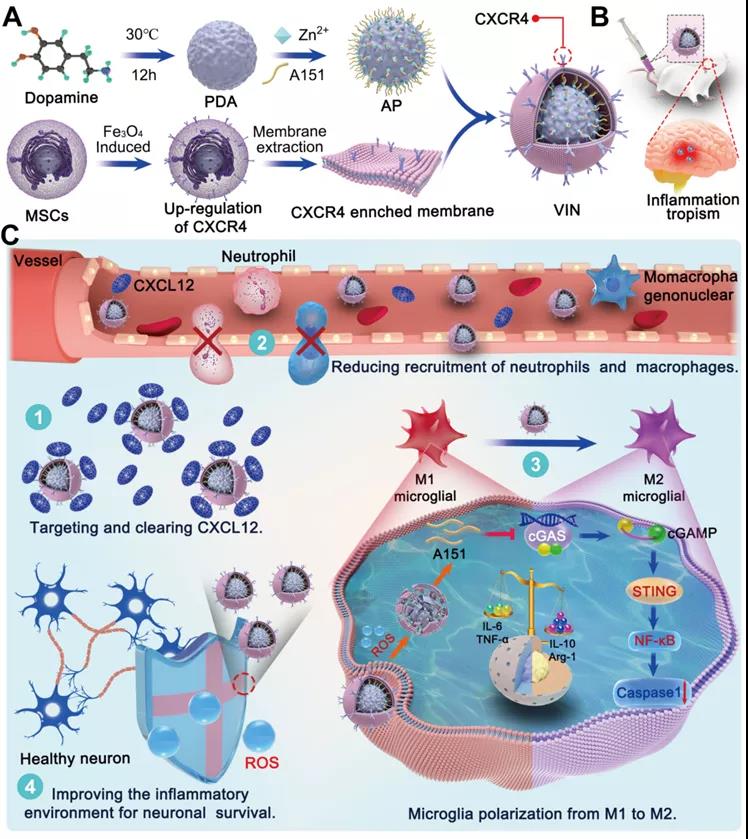
基于以上分析,郑州大学史进进教授、张开翔副教授和张振中教授构建了一种工程化CXCL12仿生诱饵集成的多功能免疫抑制纳米颗粒(VIN),用于管理过度激活的脑免疫微环境。
本文要点:
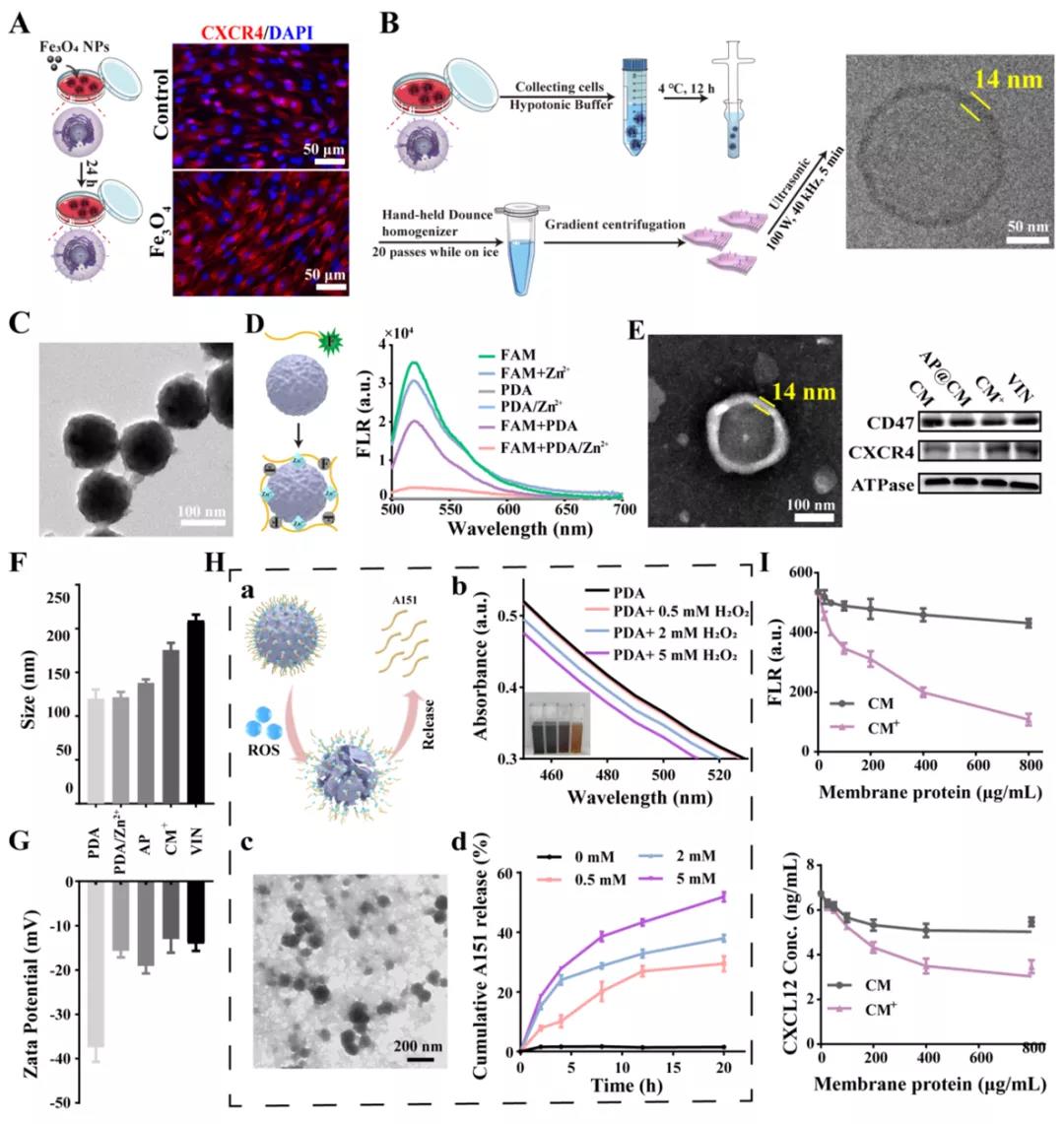
1)VIN是通过将富含CXCR4的间充质干细胞(MSCs)膜包覆在负载A151的聚多巴胺纳米球上制备而成。首先,从过表达CXCR4的MSCs中分离出的膜囊泡作为纳米颗粒的外壳,不仅可以有效靶向CXCR4-CXCL12轴,提高纳米颗粒对受损大脑的归巢,而且可以作为炎症趋化因子CXCL12缺失的“纳米诱饵”,从而切断外周炎症细胞的浸润,如中性粒细胞和单核巨噬细胞。其次,核心上的A151(端粒酶重复序列寡核苷酸,5 '-TTAGGGTTAGGTTAGGGTTAGGG-3 ')可抑制小胶质细胞cGAS-STING通路,导致小胶质细胞分化为抗炎的M2样表型。有趣的是,A151被高生物安全性的聚多巴胺纳米球(PDA,VIN的核)通过Zn2+的桥梁作用有效负载。在炎症部位高ROS环境下,PDA被ROS氧化,Zn2+络合作用消失,A151大量释放,实现脑内精准递送和可控释放。此外,PDA能有效清除炎性微环境中的ROS,保护神经细胞免受ROS诱导的凋亡。VIN整合了精确的炎症趋向性、控制药物释放、清除ROS和双重抗炎作用。
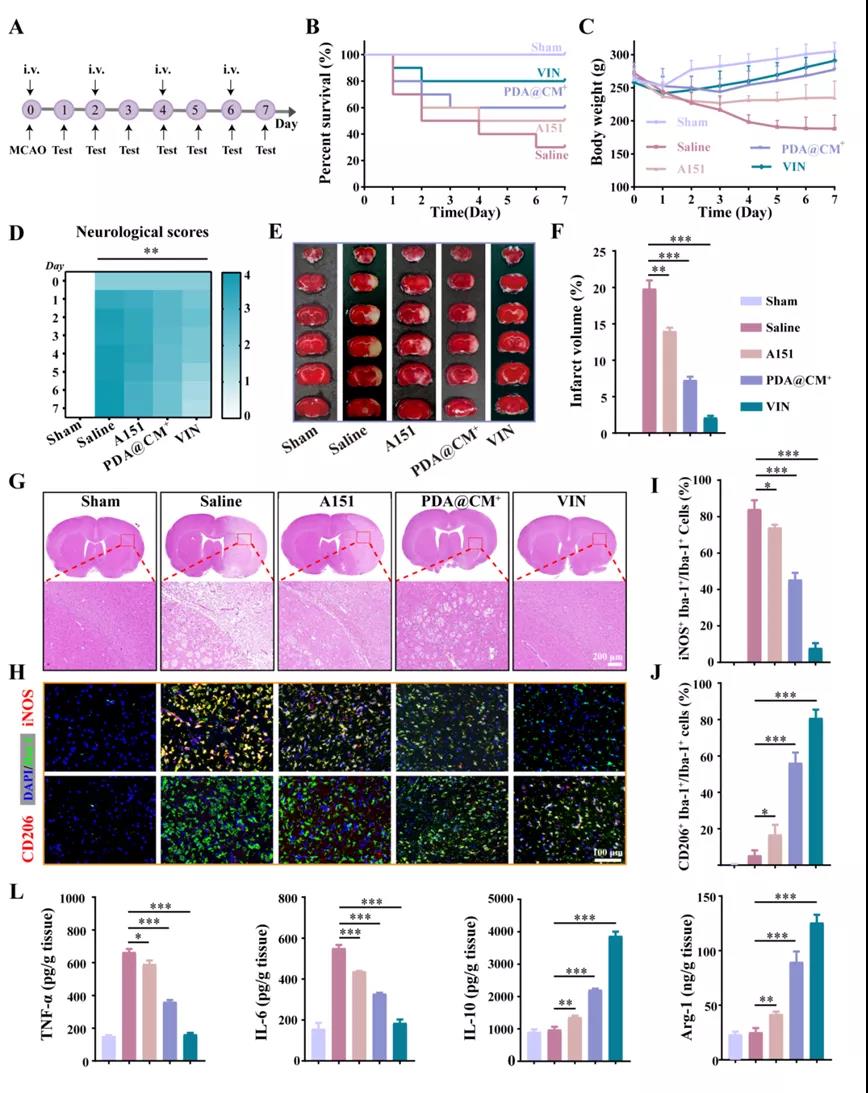
2)体外结果表明,VIN在显著改善缺血大鼠死亡率、减少梗死体积以及保护脑卒中后神经元等方面具有显著的治疗作用。
以上文章转载于微信公众号奇物观,如有侵权,请及时联系我们修改或进行删除。

