背景介绍
铜单原子纳米酶具有独特的金属活性中心和良好的微环境调节能力,能够克服传统纳米酶元素成分不均一和低密度活性位点等不足。能够在肿瘤微酸环境中发挥辣根过氧化物酶活性(POD)代谢过氧化氢产生羟基自由基,增强活性氧的生成。但是其POD活性对微环境中H2O2浓度要求较高(往往要达到50-100μM);其次,肿瘤微环境中存在谷胱甘肽,可以消耗活性氧和H2O2,降低肿瘤杀伤效率。在肿瘤微环境中,液泡型质子泵(V-ATPase)能够维持肿瘤细胞内部的中性环境,而质子泵抑制剂(PPI)能够通过抑制V-ATPase使肿瘤细胞内环境中内呈酸性环境,进而对肿瘤细胞达到抑制作用。因此构建包含铜单原子和PPIs的纳米酶可以协同发挥作用,实现对肿瘤的高效的杀伤。
成果简介
本文主要通过高温碳化法合成了铜单原子纳米材料(SAZs),通过物理挤压的方法,将PPI和SAZs与血小板膜泡合成铜单原子纳米载药系统,能够在肿瘤部位靶向富集,并在肿瘤微环境中释放PPIs,发挥增加肿瘤细胞内氢离子和H2O2水平,降低细胞内GSH水平,增加SAZs的POD催化能力,协同增加肿瘤杀伤效果,肿瘤抑制率可以达到90%。这种结合了通过调节肿瘤微环境增强铜单原子纳米酶催化作用的新型纳米载药系统为肿瘤的治疗提供了一种新的思路和解决方法。
图文导读
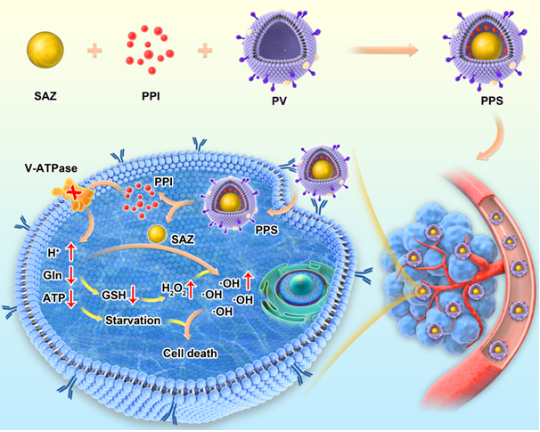
示意图:铜单原子纳米载药系统进入细胞后,可以在细胞内释放PPI,抑制V-ATPase,导致细胞内H+升高,Gln降低,ATP降低,在酸性环境下SAZ发挥POD作用分解为羟基自由基,同时GSH降低,导致肿瘤微环境中H2O2升高,另外ATP降低可以导致细胞功能不足,协同杀伤肿瘤细胞。
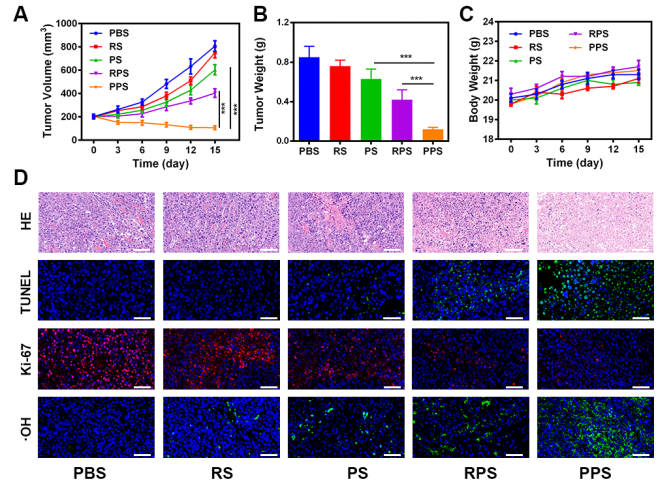
图A肿瘤体积随时间变化曲线,PPS组肿瘤体积明显缩小;图B肿瘤重量;图C荷瘤小鼠体积变化;图D不同组别HE染色,TUNEL免疫荧光,Ki-67免疫荧光,·OH免疫荧光。
以上文章转载于微信公众号NanoResearch,如有侵权,请及时联系我们修改或进行删除。

