电子皮肤可以模仿人体皮肤的感觉功能,在智能假肢、人工智能、医疗诊断与监测等领域具有广阔的应用前景。近年来,人们在制造能够模仿生物皮肤的自愈合和感知功能的电子皮肤上付出了相当大的努力。到目前为止,文献中报道的所有自愈电子皮肤都是以密封薄膜的形式制备的,这种薄膜缺乏透气性,长时间佩戴后会引起瘙痒和/或皮肤炎症。纤维膜是制备高敏感可呼吸电子皮肤的理想材料。然而,开发具有自愈性、透气性和柔韧性的电子皮肤至今仍是一个巨大的挑战,这主要是由于制备具有本征型自愈性的纤维膜的难度。

近日,东华大学丁彬研究员、李召岭研究员等人报道了一种新型的界面保护策略,首次开发了具有仿生约束结构的本征型自愈合纤维膜,并通过界面氢键将其组装成全纤维结构的电子皮肤。所开发的这款电子皮肤具有自供电、自修复、透气性、拉伸性和热变色等功能,在智能可穿戴传感系统中具有很高的应用前景。相关工作以“Superstable and Intrinsically Self-healing Fibrous Membrane with Bionic Confined Protective Structure for Breathable Electronic Skin”为题发表在最新一期的《Angew. Chem. Int. Ed.》。具体而言,研究者在这项工作中首次制备了具有仿生封闭保护结构的本征型自愈热致变色纤维膜(self-healing thermochromic fibrous membranes, STFMs)。自愈纤维由合成聚二甲基硅氧烷基聚脲(PDMS-PUa)作为主体(原始STFMs)组成,其中聚丙烯酸(PAA)和支化聚乙烯亚胺(bPEI)组成的“限制性保护层”自组装在原始STFMs的壳上,以防止与PDMS-PUa之间的超分子相互作用,从而保证了本征型STFMs的形态稳定性。由于热致变色微胶囊的引入,所得到的纤维膜表现出热致变色功能。此外,值得一提的是,在没有外部粘合剂的情况下,纤维膜的表面化学结构可以进一步调整,利用不同功能层之间界面形成的氢键来组装电子皮肤传感器。这种电子皮肤在没有外界刺激的情况下表现出自愈功能。令人惊讶的是,在水的作用下,自愈效率更高。这项工作将为仿生和高级柔性电子皮肤领域的研究提供新的方向和思路。
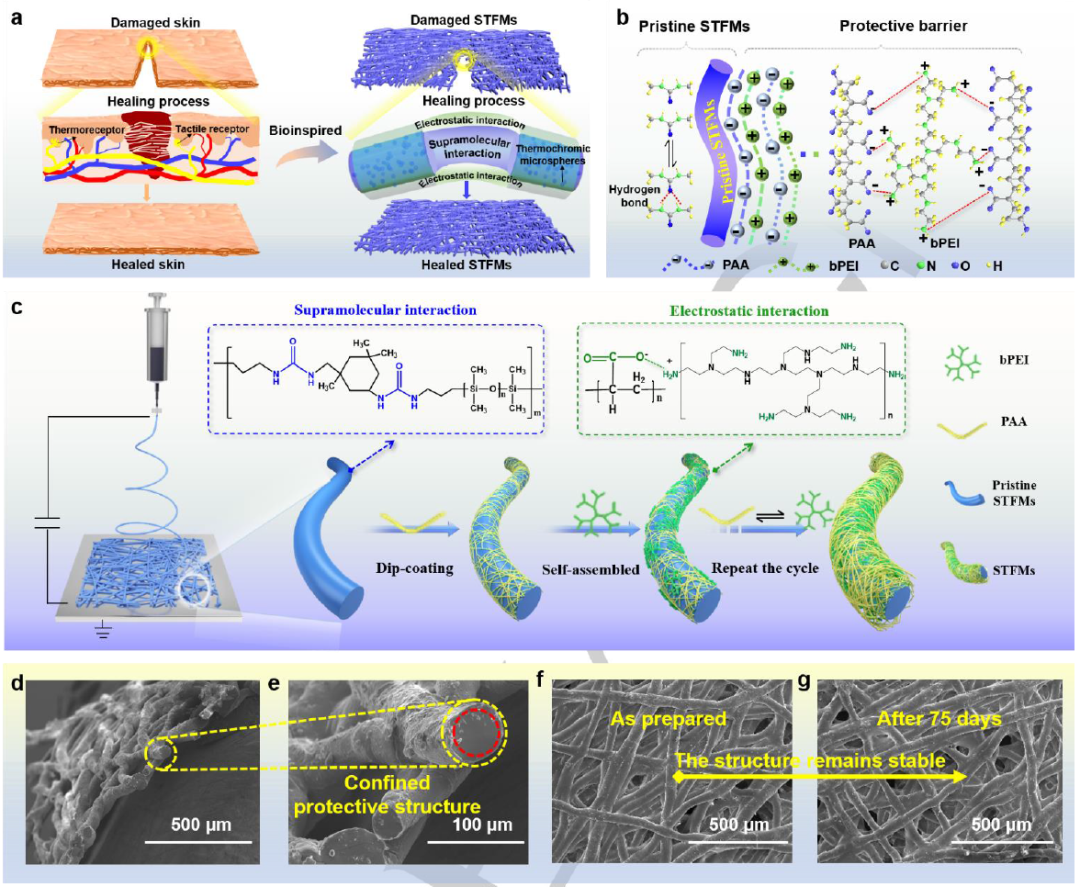
图1. 本征型STFMs的结构设计与制备。
【本征型STFMs的结构设计与制备】
如图1a所示,受生物皮肤的自愈合和感知特性(温度和触觉)的启发,基于超分子和静电相互作用,制造了本征型自愈合的热变色纤维膜。如图1b所示,将聚电解质PAA和聚电解质bPEI组成的外封闭保护层逐层自组装沉积在原始STFMs上。最终研究者选择具有3.5个组装周期的STFMs作为传感器层来开发自愈电子皮肤。图1d-e 为STFMs的截面SEM图像。可以清楚地看到,STFMs具有明显的受限结构,证实了原始STFMs的主体部分已被PAA和bPEI成功包裹,以防止单个纤维的尿素基团之间的超分子氢键相互作用。图1f-1g分别给出了刚制作的STFMs和存储75天的STFMs所获得的SEM图像的对比。结果表明,在很长一段时间内,STFMs的纤维形态保持良好,表明STFMs具有良好的稳定性。
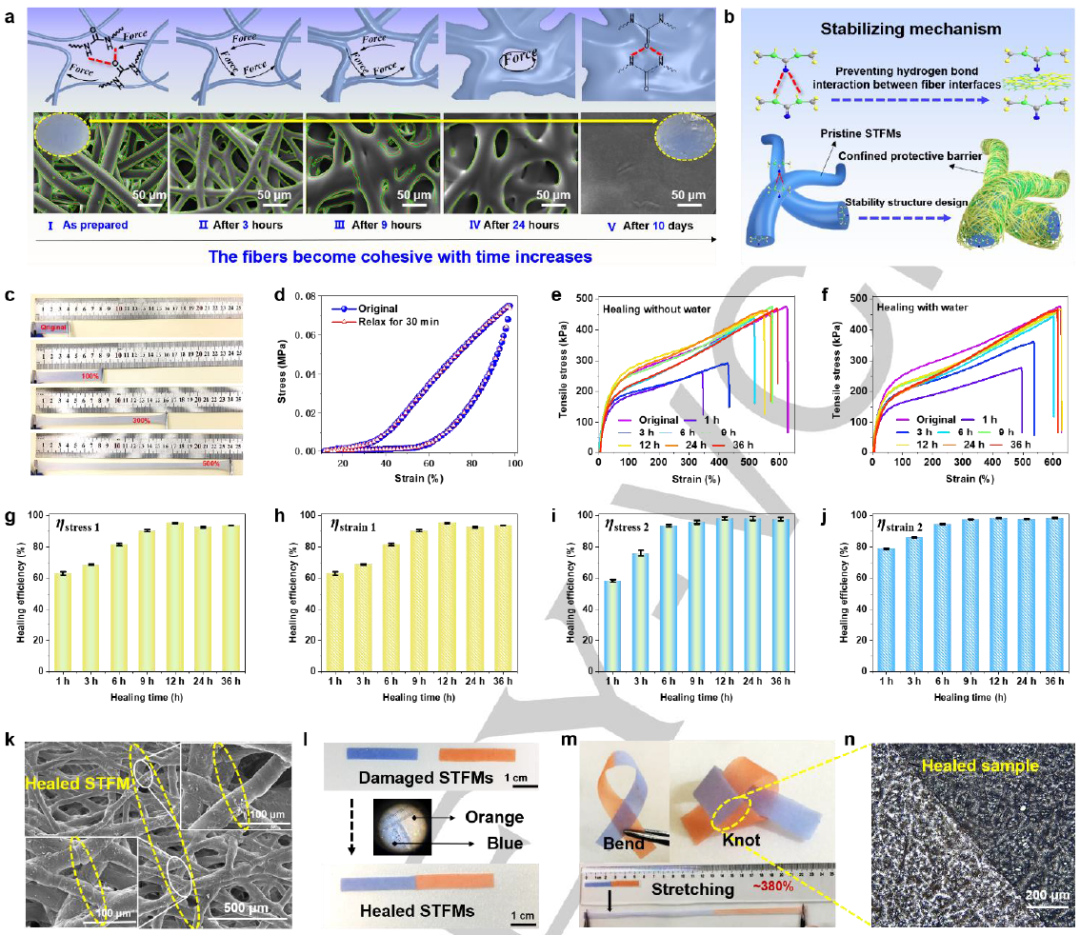
图2. STFMs的稳定性机制及自愈功能。
【STFMs的稳定性机制及自愈功能】
原始的STFMs-C6相互粘合,这是由单个纤维的尿素基团之间的分子间氢键相互作用造成的。如图2a所示,随着纤维的融合,纤维膜逐渐发展为无孔膜,表现为从无光泽的纤维材料转变为有光泽的膜材料。因此,解决这一问题的关键步骤之一是在不影响自愈性能的前提下,防止单个纤维之间的超分子相互作用。因此,利用静电效应将一个封闭的保护层自组装到原始STFMs-C6的外壳上(图2b)。这种保护屏障在日常使用条件下没有自愈能力,但它可以在水环境中通过静电相互作用进行自愈。此外,STFMs具有良好的拉伸能力(图2c)和良好的弹性(图2d),这非常有利于柔性电子皮肤的制备。此外,无论在无水还是水环境中愈合,愈合后的试样力学性能都随着愈合时间的延长而增强。图2n为愈合后的样品的光学显微镜图像,进一步证明了纤维膜的愈合行为。
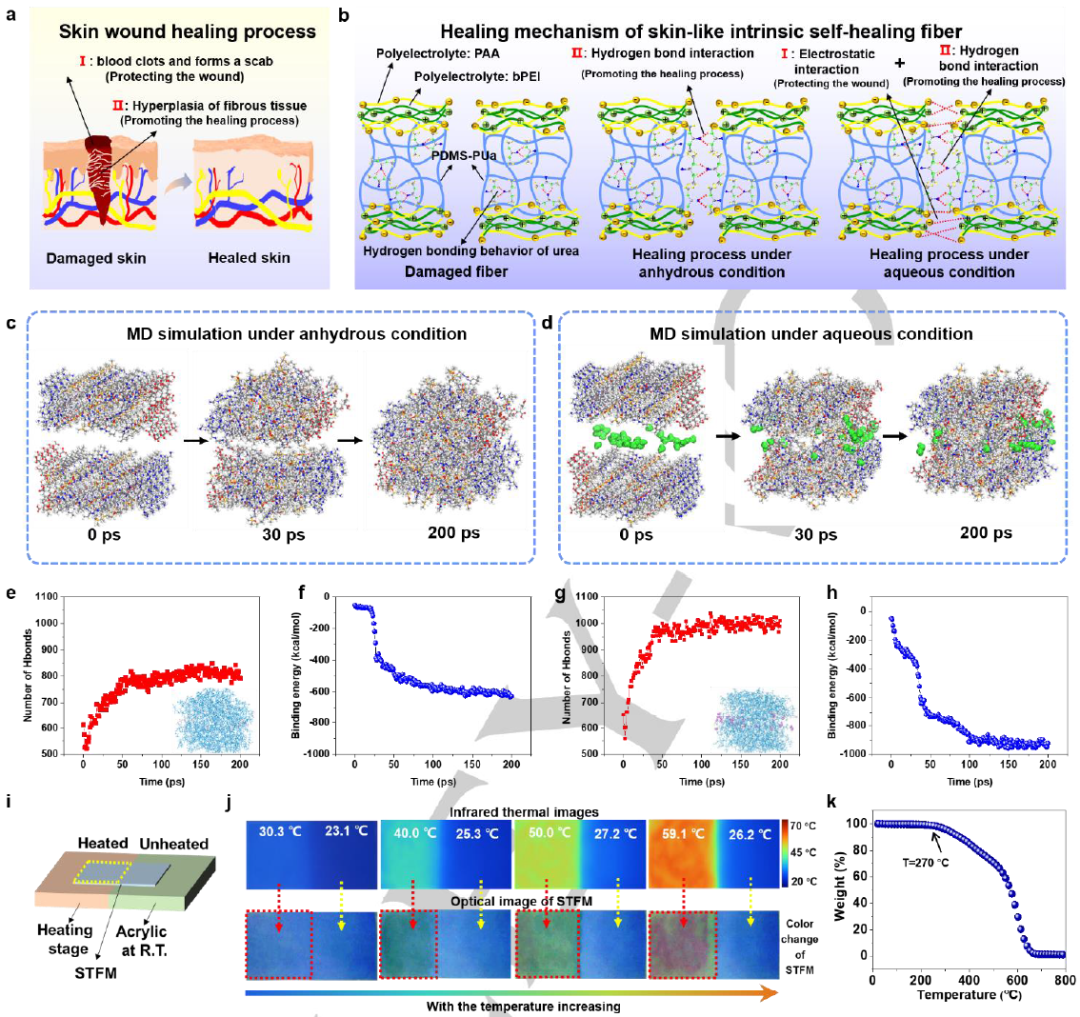
图3. STFMs的自愈机理及热变色性能分析。
【STFMs的自愈机理及热变色性能分析】
如图3a所示,皮肤伤口愈合过程主要包括皮肤表面结痂(过程一)和内部纤维肉芽组织增生(过程二)。从图3b可以看出,制备的STFMs在水环境下的自愈合过程类似于皮肤愈合过程,它由两个相似的部分组成,即外部约束结构的静电相互作用(过程一)和内部氢键相互作用(过程二)。图3c和图3d分别为无水和水条件下STFMs自愈过程的分子动力学(MD)模拟示意图。在无水条件下,尿素分子可以自发形成氢键,实现自愈能力。该模型中氢键的数量和结合能绘制在图3e和图3f中。
此外,由于引入了热致变色微胶囊,制备的STFMs具有热致变色功能。图3i描述了测试过程的原理图。从图3j可以看出,随着温度从20°C上升到65°C, STFMs的颜色逐渐由蓝色变为绿色,最后变为红色。STFMs的热重(TG)曲线如图3k所示,说明热分解温度为270℃,所制备的STFMs可以承受60℃应用所需的最高温度,没有任何问题。
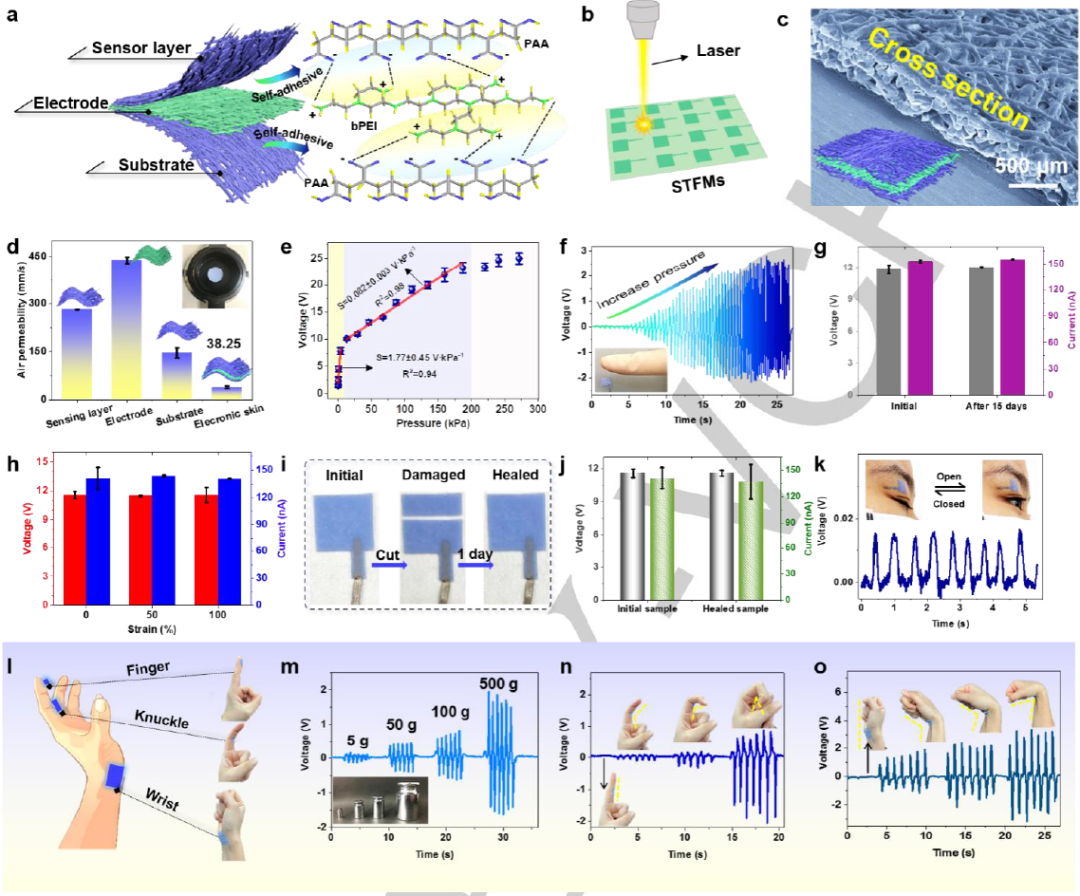
图4. 电子皮肤界面组装及其传感性能。
【电子皮肤界面组装及其传感性能】
图4a表明,通过利用STFMs界面上PAA和bPEI之间的分子间氢键,可以调整STFMs的表面化学结构,构建具有全纤维结构的自愈合电子皮肤。将不同功能层之间的界面在水的作用下组装成具有全纤维结构的本构自愈电子皮肤传感器,是自愈电子皮肤领域的突破性发展。
【小结】
这项工作报告了一个简单但有效的策略,成功地开发了具有本征自愈合和热变色纤维膜的核-壳结构。壳体内的自愈性“保护层”确保了STFMs的形态稳定性,并克服了本征自愈性纤维膜不稳定的问题。所制备的STFMs具有良好的自愈效率和稳定的形貌,优于依赖自愈剂和自愈涂层的纤维膜。此外,纤维膜的表面化学结构可以进一步调整,将这些膜组装成具有固有自愈性的全纤维结构电子皮肤。在0 ~ 15 kPa和15 ~ 200 kPa的传感范围内,检测灵敏度分别为1.77 V·kPa-1和0.082 V·kPa-1。所制备的电子皮肤具有自给自足的工作特性和良好的拉伸性能,易于与人体皮肤贴合。此外,它还显示了温度可视化响应的功能。
以上文章转载于微信公众号高分子科学前沿,如有侵权,请及时联系我们修改或进行删除。

