脓毒症(sepsis)是由病原微生物急性感染引起的先天免疫系统过度活化所导致的系统性炎性综合征,每年约有1100万人因脓毒症而死亡,占全球死亡人数的19.7%(超过因癌症而死亡的人数),但目前尚无特殊有效的治疗方法。其主要特征为在感染后出现免疫亢进和炎症因子风暴,进而加重组织损伤引发多器官衰竭,改善sepsis病理进程中免疫过度激活产生的炎症因子风暴是其治疗的关键。前期研究意外发现荷瘤小鼠可对抗脓毒症,同时流行病学研究显示,不同癌症亚型之间的sepsis发病率有很大差异,其中黑色素瘤患者的发病率显著降低,这可能与神经内分泌组织来源肿瘤的防御机制有关。由于肿瘤患者机体通常处于由肿瘤引发的免疫抑制状态,这提示肿瘤对机体的免疫抑制作用一定程度上或可对抗sepsis引起的免疫过度激活状态,进而使机体免疫达到平衡,起到缓解sepsis的作用。学习并利用肿瘤的免疫抑制性这一“盾”,来防御脓毒症的免疫过度激活这一“矛”,将可能是脓毒症炎症因子风暴仿生治疗的新策略。
近日,南开大学药学院与天津市第四中心医院、天津市第三中心医院合作,从“机体免疫稳态调节”的角度提出了“仿生肿瘤免疫抑制性外泌体”的理念,用于改善脓毒症相关炎症因子风暴,阻遏脓毒症进展(图1),相关工作发表于Advanced Materials,并被选为frontispiece。
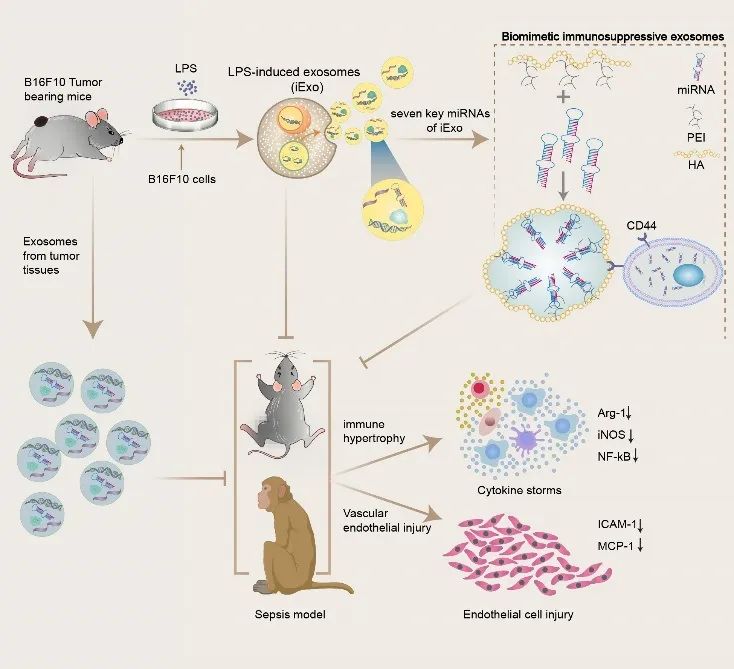
图1. 仿生肿瘤免疫抑制外泌体减轻脓毒症炎症因子风暴的研究思路。
基于前期工作中意外发现荷瘤小鼠可对抗脓毒症的现象,研究团队首先验证了荷瘤处理对于脓毒症模型(“tumor bearing-then-sepsis”)的改善作用;并且发现负载在小鼠体内的肿瘤细胞,在模型建立后主要通过其分泌的外泌体发挥对抗脓毒症的作用,增加模型小鼠存活率。为了在体外模拟“tumor bearing-then-sepsis”模型中肿瘤细胞外泌体的功能,课题组尝试对体外培养的肿瘤细胞用LPS进行诱导,发现LPS处理后肿瘤细胞分泌的诱导性外泌体(iExo)与普通肿瘤细胞分泌的外泌体(nExo)相比具有更好的改善sepsis的作用(图2)。同时,iExo比nExo粒径更大,内径/外径的比值更高,表明其可能负载了更多的内容物。细胞水平实验显示,iExo能够抑制LPS诱导的巨噬细胞炎症反应,改善炎症导致的血管内皮细胞损伤。进一步测序分析发现iExo主要通过miR-7651-5p、miR-615-5p等7种关键的miRNA发挥免疫抑制调节作用(图3)。
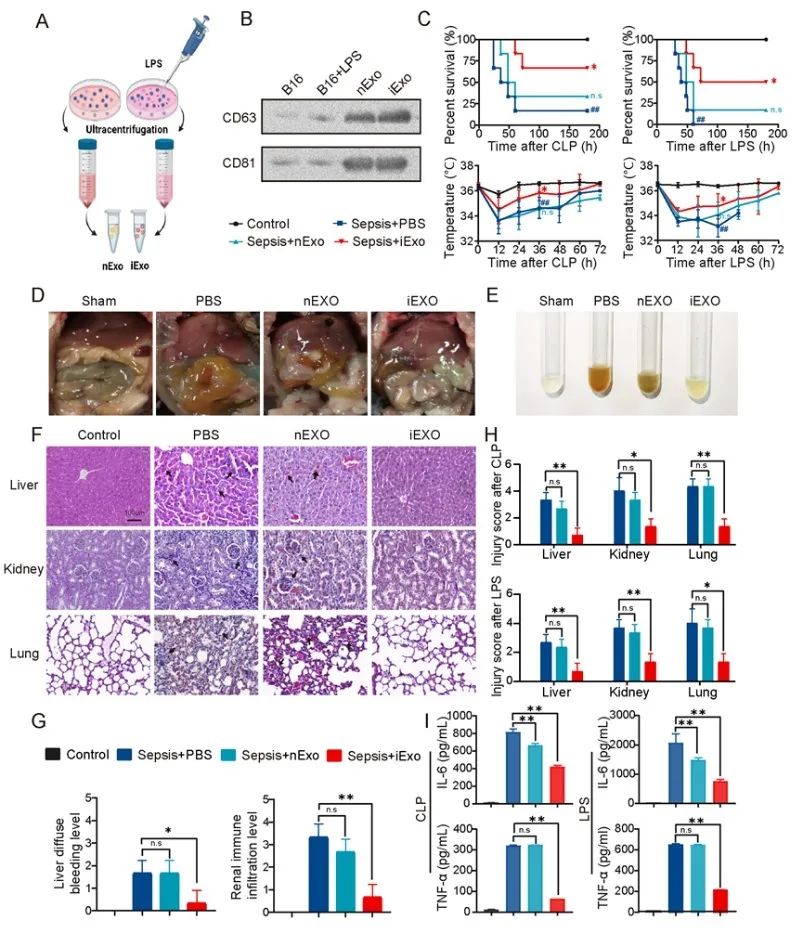
图2. LPS处理B16-F10细胞后分离的诱导型外泌体(iExo)可以改善多种脓毒症小鼠模型的疾病进展。
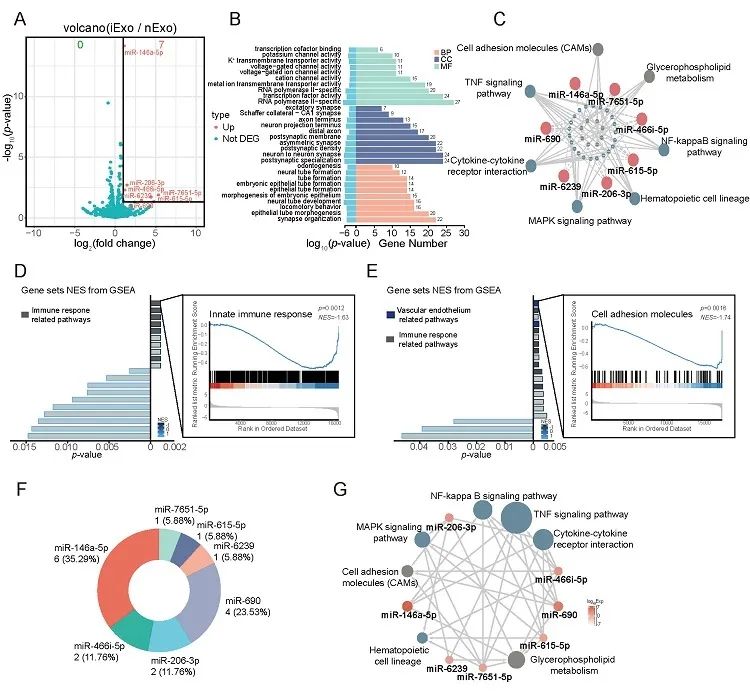
图3. iExo富含具有免疫调节作用的关键miRNAs分析。
为了实现仿生模拟肿瘤免疫抑制外泌体的功能,研究团队利用HA-PEI纳米颗粒负载不同配比和组合的上述miRNAs,制备了“Exosome-mimics”。发现与天然iExo miRNAs配比相同的Exosome-mimics抑制LPS诱导的炎症反应及改善血管内皮细胞损伤的作用更强(图4),这表明细胞应激产生的miRNAs存在编码特性,其间比例与生物学功能具有密切关联性。最后在小鼠和食蟹猴模型中,“Exosome-mimics”也表现出较好的脓毒症改善作用和跨物种特性,可改善血液、生化等指标及一般状态,有望开发为治疗脓毒症的药物。
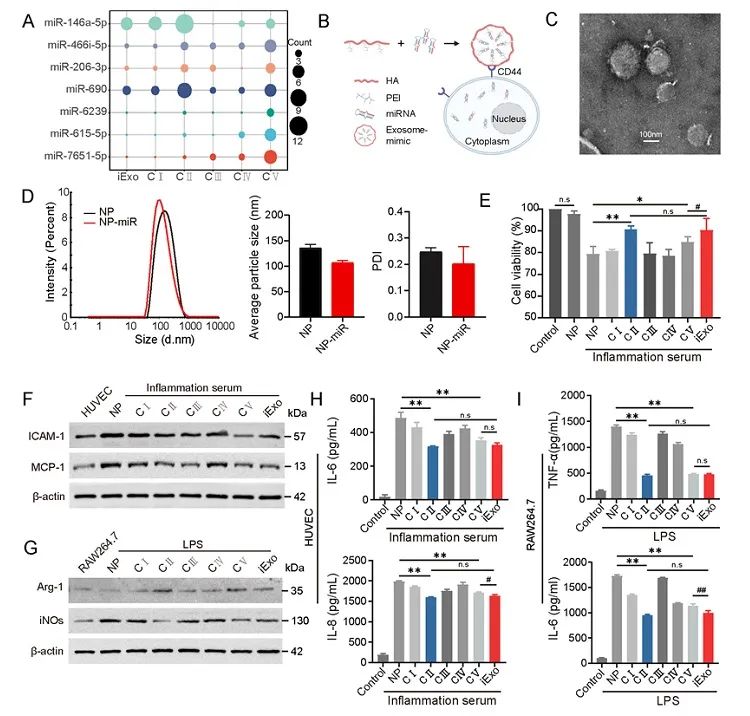
图4. HA-PEI负载miRNAs制备的仿生肿瘤免疫抑制性外泌体(Exosome mimics)可以抑制LPS诱导的炎症反应和内皮细胞损伤。
研究亮点:
(1)本研究仿生肿瘤发挥免疫抑制性的主要媒介——外泌体,设计exosome mimics作为“盾”抑制脓毒症中免疫过度激活带来的损伤,调节机体免疫正常化,为外泌体及衍生核酸药物治疗脓毒症和炎症因子风暴相关疾病提供了新的思路。该研究通过学习肿瘤的特性挖掘生物体内潜在的平衡能力以治疗其他疾病。
(2)利用细菌胞壁主要成分——LPS模拟脓毒症的体内环境,刺激肿瘤细胞产生的iExo具有改善炎症风暴的作用,而静息状态下产生的普通外泌体则几乎没有作用。这也提示,肿瘤细胞外泌体的功能与外部的刺激条件关系密切,为更多功能特异性外泌体的开发提供了依据。
(3)采用HA-PEI纳米颗粒作为递送载体对7种特异性miRNAs进行包裹来模拟外泌体,可发挥与天然外泌体近似或更强的治疗作用,有望解决外泌体难以规模化生产以及质控困难的问题。
该工作由南开大学李伊楠博士、张恒博士为论文共同第一作者,南开大学孙涛教授、刘慧娟副研究员,天津市第四中心医院张杨主任,天津市第三中心医院高文卿主任为共同通讯作者。
以上文章转载于微信公众号X-MOL资讯,如有侵权,请及时联系我们修改或进行删除。

