近些年来,科学家们试图通过模仿大自然的生物矿化过程(如珊瑚、海胆形成外骨骼保护),设计出集生物和材料功能于一体的下一代生物纳米系统。其中,最具代表性的成果之一是将金属有机框架(MOF)原位组装到各种生物实体上,包括细菌、细胞、蛋白质、DNA和多糖等。这种精致的MOF生物纳米系统一方面可以为环境敏感的生物实体提供外骨骼保护,另一方面,得益于MOF的多孔网状结构,也能够使包封的生物实体具有很高的可及性,从而衍生了许多无法通过单个组件实现的新应用。例如,当ZIF-8在过氧化氢酶和葡萄糖氧化酶等特定酶上原位生长时,嵌入的酶可以作为“发动机”,通过生物催化有效地将化学能转化为动能,赋予ZIF-8生物复合材料自推进的运动能力。基于酶的高催化效率和底物特异性,这种生物矿化过程为设计在酶底物作用下具有可控运动行为的微米和纳米级机器人提供了一种有效的策略,可应用于消除污染、生物分子识别、靶向药物递送和肿瘤治疗等。
诚然,基于金属有机框架的生物矿化工程是构筑刺激响应智能材料的新兴策略,然而,这一策略目前仍然存在着诸多挑战。例如,作为主流的生物矿化涂层的金属有机框架ZIF-8的晶体学孔窗狭窄(约3.4 Å),不仅会抑制客体分子的扩散过程,还会限制后续的多样化应用。同时,ZIF-8的生物矿化高度依赖于蛋白质与金属离子之间的静电相互作用,但许多金属离子表现出较高的生物毒性,并会扰乱了蛋白质的原生构象。此外,ZIF-8框架的酸敏感特性也会大大限制所设计的生物纳米系统的应用场景。
氢键有机骨架(Hydrogen-bonded Organic Frameworks, HOFs)是一类由离散有机单体通过氢键作用链接而成的多孔有机框架,具有结晶条件温和溶液加工性高等优点。同时,无金属的拓扑结构赋予了HOFs材料更高的生物安全性。有鉴于此,中山大学化学学院陈国胜副教授报道了一种以HOFs作为外骨骼的仿生组装策略,用于构筑自推进的氢键酶复合框架(图1)。过氧化氢酶(CAT)是一种可高效分解H2O2产生O2的生物催化剂,研究人员发现CAT表面氨基酸残基可与芘核羧酸有机配体形成氢键界面作用,促发具有光催化活性的HOF在CAT表面原位生长。形成的CAT@HOFs生物复合框架具有优异的结构稳定性和创纪录高的CAT负载量,可高效催化燃料“H2O2”产生的O2气泡,进而推动HOFs在水中运动(图2)。此外,CAT@HOFs组装形成长程有序的介孔通道,在自推进运动过程中可作为“口袋”提高污染物的去除效率;同时,连续的产氧功能和快速自推进行为也证明可协同增强HOFs骨架的光催化活性 (图3)。
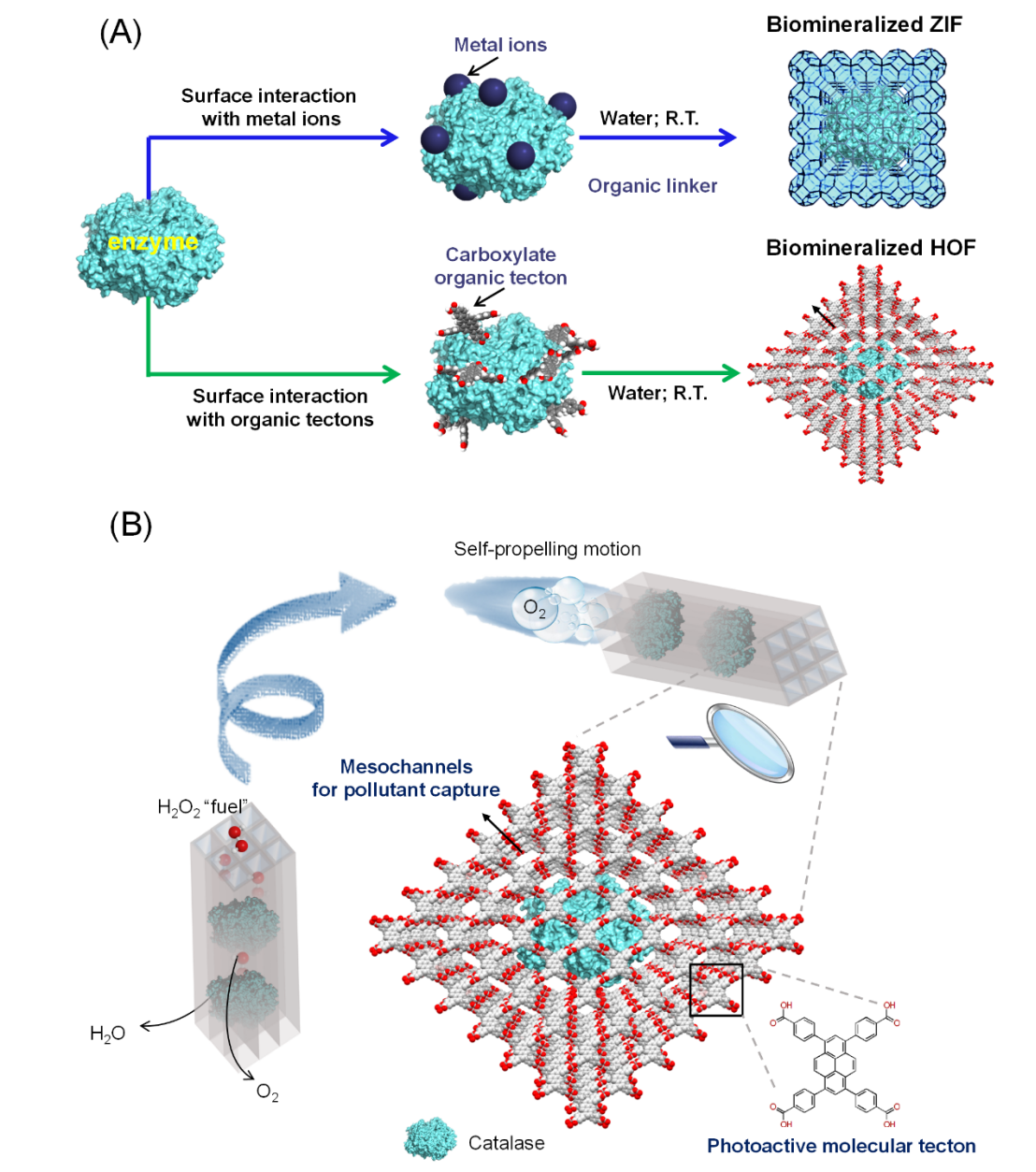
图1(A) 基于ZIF的生物矿化策略和基于HOF的仿生组装策略的示意图。(B) CAT@HOF具有用于污染物去除和增强光催化性能的自推进运动行为。
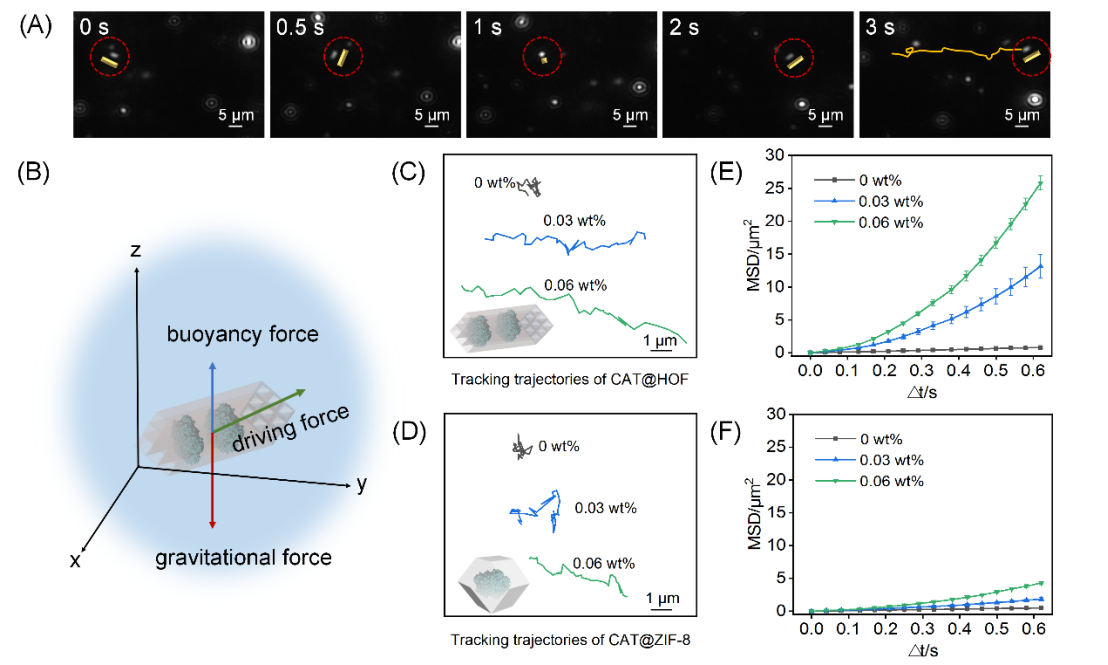
图2 (A) CAT@HOF的自推进运动。[H2O2] = 0.06%(B)CAT@HOF的受力分析示意图;(C)-(F):系列H2O2浓度下CAT@HOF和CAT@ZIF-8的自推进运动轨迹及MSD曲线。
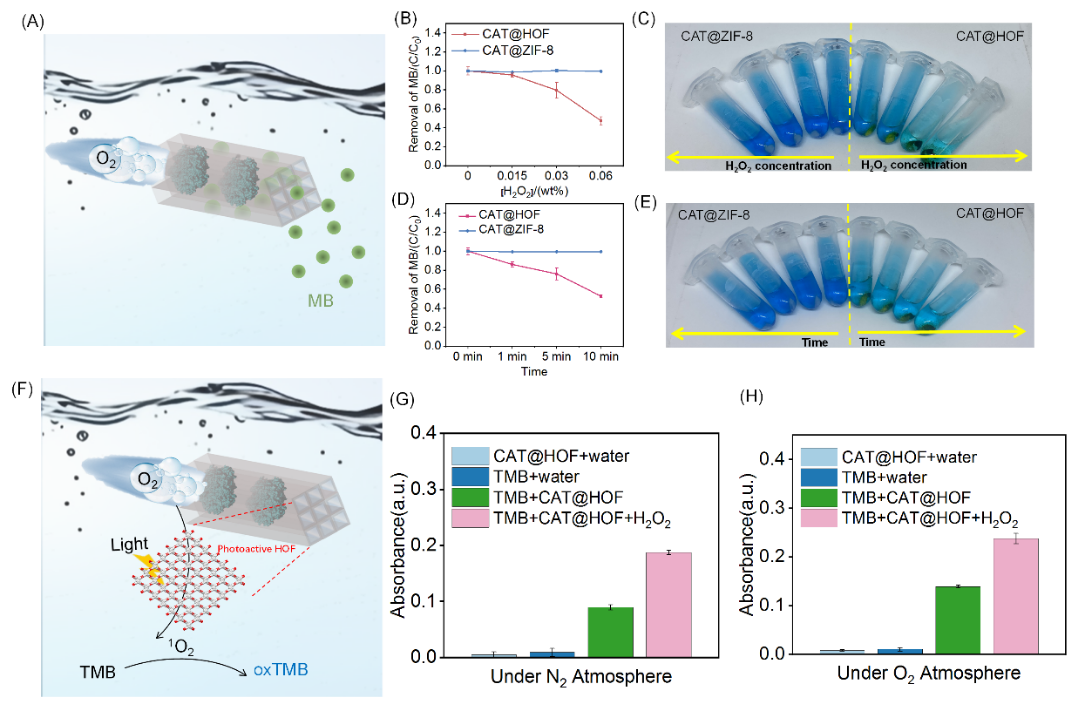
图3(A) CAT@HOF作为污染物去除的动态吸附剂的示意图。(B) 不同H2O2浓度下MB染料的去除效率和(C)相应的实物照片;(D) 在0.03 % H2O2浓度条件下, MB染料的去除效率随时间变化的曲线和(E)相应实物照片。(F)CAT@HOF.自推进行为协同增强光催化性能的示意图;(G)、(H):N2气氛下和O2气氛下CAT@HOF光催化氧化TMB的性能对比。
致谢:本文的通讯单位为中山大学化学学院。本工作受到国家自然科学基金项目(22174164、22104159、21904146)和广东省自然科学基金(2020A1515010824、2019A1515011722)的资助。

