乳腺癌严重威胁女性生命健康,转移性乳腺癌发展过程中最致命的阶段,目前尚且无法治愈。乳腺癌转移具有器官倾向性,骨是所有亚型乳腺癌远端转移的最常见部位,其治疗仍是医学界面临的重要难题。一方面,骨转移通常具有多发病灶,目前临床上主要采用全身化疗的方法进行抗肿瘤治疗,具有较强的毒副作用,严重影响治疗进程。其次,骨转移肿瘤细胞会通过骨转移“恶性循环”导致一系列骨相关事件。其中,骨癌痛是骨转移肿瘤主要并发症之一,也是造成患者生存质量下降的重要原因。持续疼痛不仅严重影响患者生活质量,还对肿瘤发展具有一定的促进作用。因此,在进行抗肿瘤同时,辅助以镇痛治疗,不仅能显著提高患者的生活质量,还能在一定程度上提高抗肿瘤疗效。据文献报道,局部炎症反应区域的神经末梢处阿片受体表达量显著增多,局部使用阿片类镇痛药可产生显著的镇痛作用。
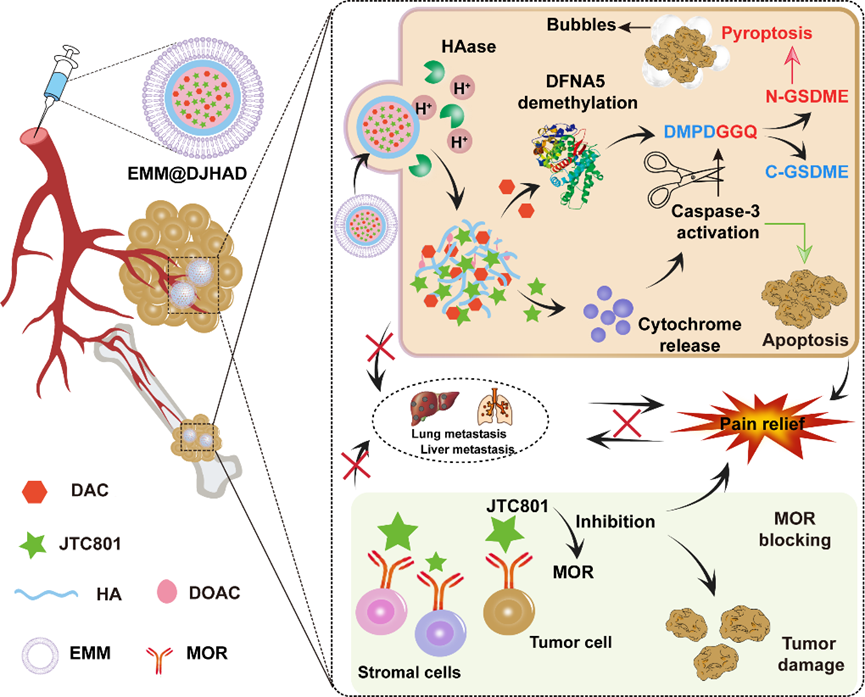
图一. 仿生纳米递药系统EMM@DJHAD的纳米粒行为调控、抗肿瘤及镇痛作用机制图。
近日,郑州大学王蕾教授团队构建一种仿生纳米递药系统,用于乳腺癌骨转移及癌症相关疼痛的同步治疗。在该项研究中,作者利用基于骨转移肿瘤微环境慢性炎症以及局部炎症反应区域的神经末梢处阿片受体表达量显著增多的特点,利用巨噬细胞膜的炎症趋向性,构建了一种M1型巨噬细胞膜(EMM)仿生的纳米药物递送系统。一方面,该仿生递药系统通过炎症趋向性,实现多病灶同步靶向。随后,地西他滨联合JTC80诱导肿瘤细胞发生高炎性细胞焦亡。杀伤肿瘤细胞的同时,炎性环境招募更多EMM@DJHAD,实现炎症环境介导的靶向增强效应,从而连续调控纳米药物的体内分布行为,显著降低全身化疗引起的毒副作用。另一方面,JTC801对炎症部位MOR的拮抗作用能够有效减弱外周感受器敏感性,在初级神经元处阻断疼痛的传导,从而有效缓解肿瘤负荷及癌症治疗所诱导的疼痛。该项工作充分考虑转移瘤治疗过程中微环境的变化,动态调控纳米药物的体内分布行为,为乳腺癌骨转移及癌症相关疼痛的同步治疗提供了一种全新的功能化纳米制剂。
相关研究成果以“Dynamic Regulation of Drug Biodistribution by Turning Tumors into Decoys for Biomimetic Nanoplatform to Enhance the Chemotherapeutic Efficacy of Breast Cancer with Bone Metastasis”为题发表在Exploration上。相关研究得到了国家自然科学基金、河南省优势学科培育联合基金、中原科技创新领军人才、中国博士后基金等项目的支持。
以上文章转载于微信公众号MaterialsViews,如有侵权,请及时联系我们修改或进行删除。

